IIS Aragón

“Estudiamos los mecanismos con los que nuestro sistema inmunitario reconoce y elimina las células tumorales”
Dr. Julián Pardo
Investigador ARAID en IIS Aragón/Universidad de Zaragoza
El Dr. Julián Pardo dirige el grupo de investigación Inmunoterapia, Inflamación y Cáncer del Instituto de Investigación Sanitaria Aragón, en el Centro de Investigación Biomédica de Aragón (CIBA). Hemos hablado con él para conocer cuáles son sus principales líneas de investigación.
¿Cuál es la estructura del grupo de Inmunoterapia, Inflamación y Cáncer que dirige?
El grupo nació en el año 2012 y actualmente está formado por 20 personas. Nuestro trabajo se centra en conocer la influencia de los procesos de muerte celular e inflamación en el sistema inmunológico a través de diversas líneas de investigación.
¿Cuáles son?
La primera línea se ocupa de la inmunoterapia en inflamación y cáncer. En concreto, su labor está relacionada con el estudio de la función de los linfocitos T citotóxicos (CTL) y de las células Asesinas Naturales/NK (y de algunos de sus componentes principales, como la perforina y las granzimas) durante la inmunidad frente al cáncer y durante el desarrollo de enfermedades inflamatorias/autoinmunes, cuya cronificación puede originar cáncer, como el colorrectal. Con estos trabajos queremos mejorar el conocimiento sobre cómo estas células nos protegen del cáncer e infecciones y, por otro lado, qué ocurre cuando funcionan mal e inducen una enfermedad o incluso la aparición de un cáncer.
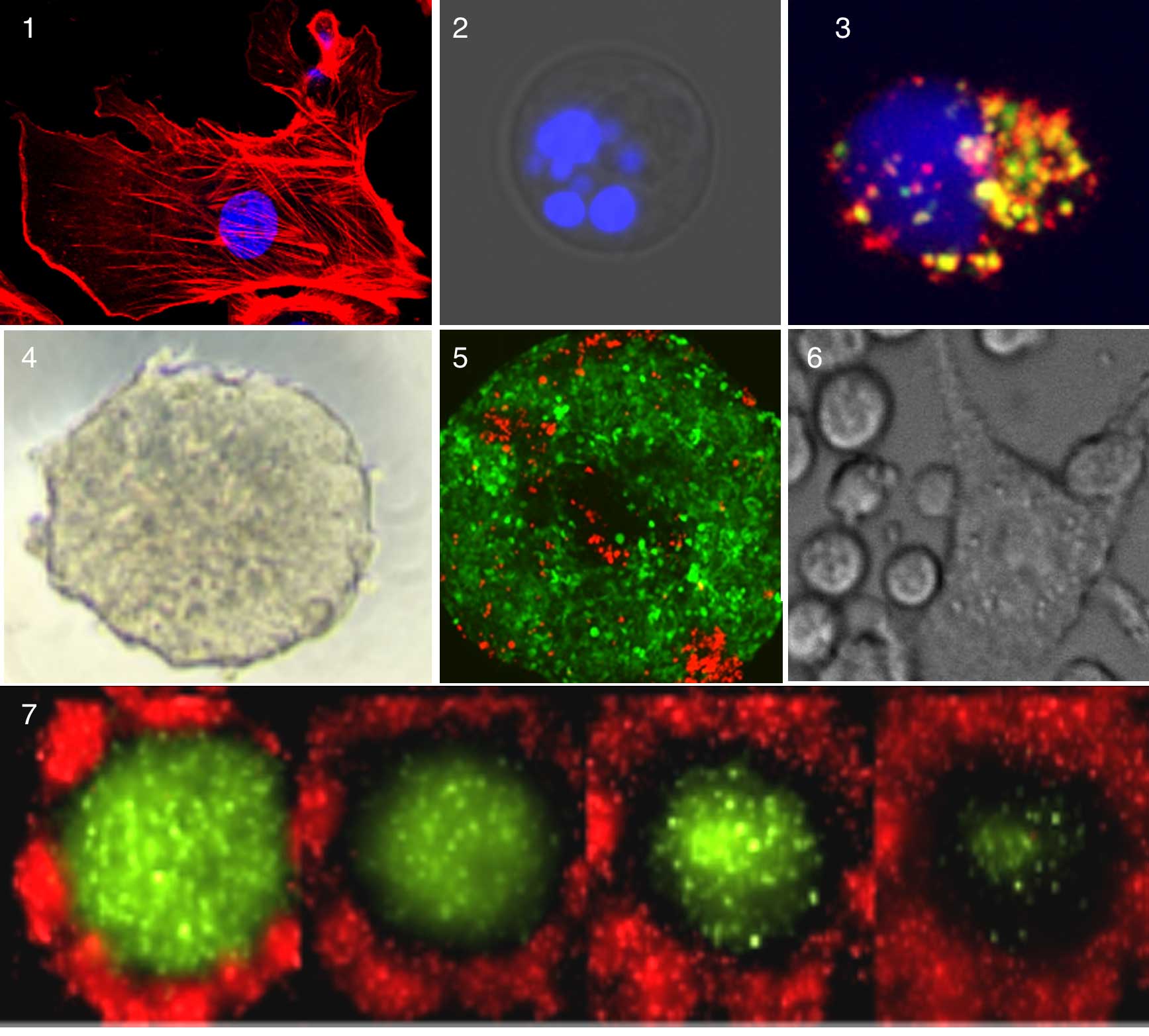
Visión gráfica del estudio de la inmunoterapia en cancer. 1. Célula de sarcoma teñida con colorantes fluorscentes para el citoesqueleto (rojo) y el núcleo (azul). 2. Célula de sarcoma muerta por la acción de linfocitos T citotóxicos anti-tumorales. 3. Imagen de un linfocito T citotóxico anti-tumoral. 4. Imagen tridimensional de un tumor de cancer colorectal humano (Esferoide) reconstruido en el laboratorio. 5. Imagen de un tumor de cancer colorectal (teñido en verde) infiltrado por células Asesinas Naturales (NK) (teñidas en rojo). 6. Detalle en gran aumento de células NK intentando eliminar una célula de cancer colorectal humano. 7. Imagen de células NK (teñidas en rojo) eliminando el tumor de cancer colorectal teñido en verde.
¿Hablamos de investigación aplicada?
A partir de este conocimiento, desarrollamos otras líneas de investigación traslacional enfocadas al desarrollo de inmunoterapia basada en células NK, más efectivas contra el cáncer, o de fármacos para bloquear las granzimas durante enfermedades autoinmunes o inflamatorias sin inducir inmunosupresión y, por tanto, sin dejar al paciente expuesto a infecciones o a cáncer.
Mencionó antes la muerte celular.
Así es. Las células tienen un periodo de vida concreto tras el que mueren y son sustituidas por otras nuevas. Si una célula muta, no se muere, y entonces el organismo tiene dos vías para solucionar el problema: intentar reparar la mutación o activar el programa de muerte celular para que la propia célula se suicide. Si aun así no muere, puede proliferar y dar lugar a un cáncer. En este punto es clave la acción del sistema inmunitario.
¿Qué estudian en este proceso?
Estudiamos los mecanismos de muerte celular por los que nuestro sistema inmune (las células NK y los CTL) elimina esas células tumorales. Analizando cómo las células tumorales evitan la acción de las células NK podríamos desarrollar protocolos para modificarlas y que así pudieran acabar con los tumores, tanto en adultos como en casos de cáncer infantil. Este conocimiento nos serviría también para predecir si las células NK y/o CTL serían efectivas para tratar cánceres hematológicos y sólidos con mutaciones de resistencia a la quimioterapia y la radioterapia.
En este sentido, el programa de investigación en inmunoterapia de células NK en cáncer infantil, en colaboración con el equipo de Carlota Calvo (Hospital Miguel Servet) está financiado por la Asociación de Padres de Niños con Cáncer de Aragón (ASPANOA), la Fundación Inocente Inocente, la Carrera de la Mujer de Monzón y el Gobierno de Aragón. Por otra parte, el proyecto de investigación sobre el papel de CTL y NK en la generación de enfermedades inflamatorias y autoinmunes y en la generación de cáncer colorrectal cuenta con la financiación del Ministerio de Ciencia y Universidad y del Gobierno de Aragón.
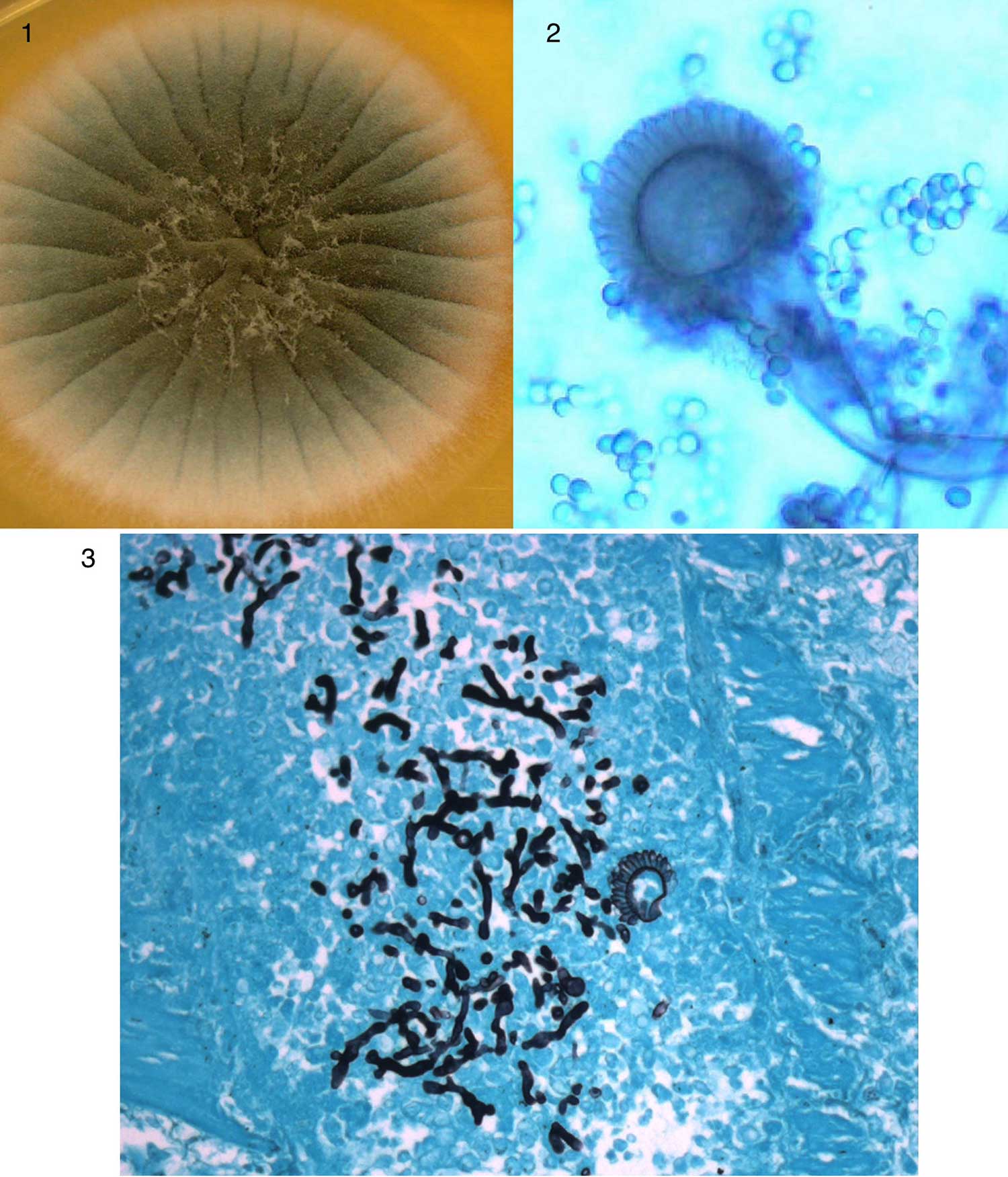
Visión del moho Aspergillus en sus diferentes formas. 1. Una colonia de Aspergillus fumigatus en una placa de cultivo de laboratorio. Se aprecia el tono gris/verdoso de las esporas en la superficie. 2. Imagen al microscopio de una de las terminaciones de una hifa de Aspergillus fumigatus, denominada conidiófora, cargada de espora/conidias del moho. 3. Imagen al microscopio de una sección de tejido pulmonar de un animal con aspergilosis invasiva. También se puede apreciar un conidióforo cargado de esporas.
Pero el cáncer no es la única línea de investigación…
La segunda gran línea de trabajo se centra en las enfermedades inflamatorias y autoinmunes y en el estudio de cómo esas mismas células (NK y CTL) favorecen los daños en los tejidos sanos durante este tipo de enfermedades, como son la sepsis bacteriana, la artritis reumatoide o la colitis ulcerosa. También estudiamos el papel de la inflamación mediada por las granzimas en carcinogénesis.
Por último, en relación con deficiencias en la inmunidad de pacientes con cáncer, buscamos nuevos biomarcadores específicos y tempranos para el diagnóstico de aspergilosis invasiva.
¿Qué es la aspergilosis invasiva?
Es una infección hospitalaria que contraen pacientes inmunodeprimidos, como es el caso de algunos niños y adultos con cáncer, y que compromete su supervivencia. Un nuevo biomarcador, bismetilgliotoxin, desarrollado y patentado por el grupo, está siendo testado en pacientes del Hospital Infantil Miguel Servet y en pacientes adultos del mismo hospital. Este trabajo lo coordina Eva Galvez Investigadora del Instituto de Carboquímica (CSIC) junto con el equipo de Antonio Rezusta (Hospital Miguel Servet). El principal problema para el tratamiento de este hongo es que los actuales detectores son lentos y en ocasiones dan falsos negativos, retrasando el inicio de la medicación. Sin embargo, este nuevo biomarcador podría ser capaz de detectar antes la infección permitiendo un tratamiento mas temprano como hemos visto en algunos casos de cáncer infantil.
Compartir